- 首页
- 论文服务
- 科研支持
- 访学通
- 美捷登学院
T7耐高温高产量RNA合成试剂盒GS™ T7 Thermostable and High Yield RNA Synthesis Kit
产品规格

产品简介
T7耐热RNA聚合酶可在更高的温度下进行体外转录。它可在37~52℃条件下进行高效的体外转录,最佳温度为37℃,50℃反应条件下仍然保留60%以上的活性,而野生型在此温度下无活性。在30 µL标准体系中,以1 µg本试剂的Control template为模板可产生150-200 µg的产物,转录长度可达5000 nt。
T7高产耐热的RNA合成试剂盒可在体外高效合成多种类型的RNA,如mRNA、lncRNA、shRNA等。这种高温的反应特性有益于以下几个方面的实验:(1)提升了GC含量较高RNA的转录效率;(2)提升了长片段RNA的合成能力;(3)在使用帽类似物时,提高了共转录的加帽效率;(4)减少了dsRNA副产物的形成,降低了合成RNA的免疫原性。
利用该试剂盒得到的RNA适用于多种下游应用,如RNA结构和功能研究、反义RNA及RNAi实验、微阵列分析、显微注射、体外翻译和RNA疫苗等。
T7 RNA Polymerase对T7噬菌体启动子具有高度的特异性,并可以其作为启动子,DNA作为模板体外合成正义链或反义链RNA。双链线性平末端或5’突出末端DNA均可作为T7 RNA Polymerase的底物模板,因此线性质粒、PCR产物均可用作体外合成RNA的模板。
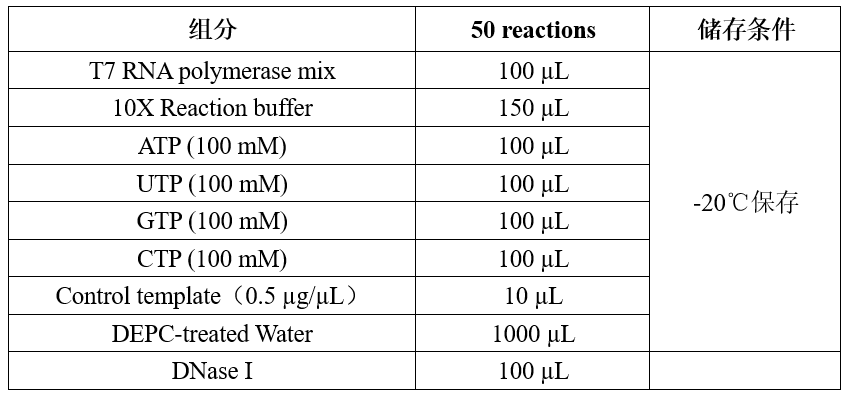
产品组分
质量控制
1、无RNase、DNase污染。
2、经考马斯亮蓝染色的SDS-聚丙烯酰胺凝胶染色判断,T7 RNA Polymerase纯度>95%。
操作流程
一、DNA模板制备
常用于体外转录的DNA模板一般为PCR产物、线性化质粒、合成的寡聚核苷酸。
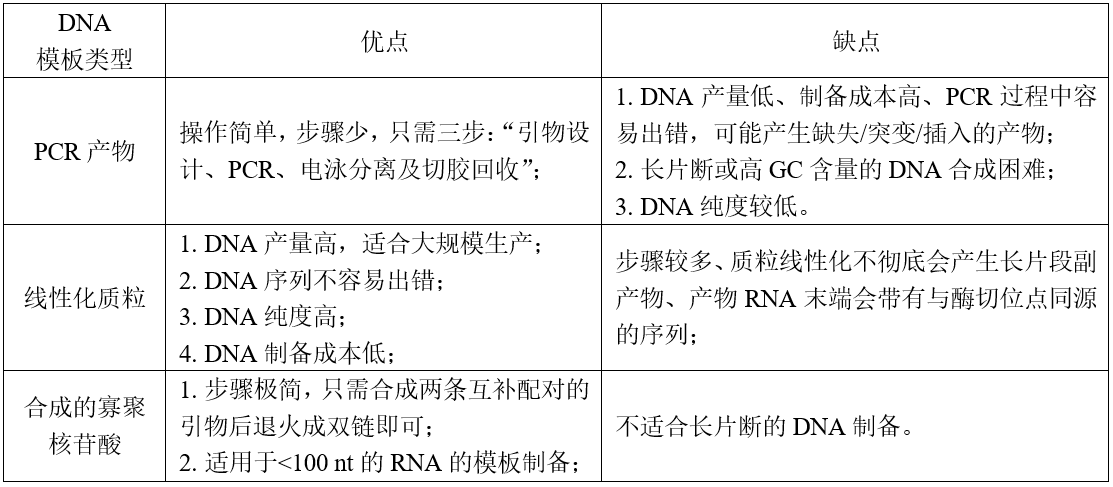
1.PCR产物
通过在上游引物的5’端加上T7启动子序列,由PCR反应即可产生带T7启动子的双链产物。如果需要生产双链RNA,则下游引物5’也需要添加T7启动子序列。
2.线性化质粒
1)将“T7启动子-目标片段-酶切位点”的DNA片段通过酶切连接/同源重组的方法插入pUC19等质粒中;
2)测序正确后,通过单限制性内切酶进行酶切,获得线性化质粒。
注:a. 环状质粒由于没有有效的终止,会转录出不同长度的RNA产物,为了得到特定长度的RNA,质粒必须完全线性化;
b.质粒线性化所选限制酶需要在启动子区域右侧、插入DNA片段的下游,且在插入DNA片段中无识别位点。选择的限制酶要能形成5’突出或者平滑末端;
c. 为了避免蛋白及盐离子等对体系的影响,质粒线性化后建议纯化后再作为模板进行体外转录。
3.合成的寡聚核苷酸
合成的带有T7启动子的DNA片段也可以作为体外转录的模板。
二、转录原理
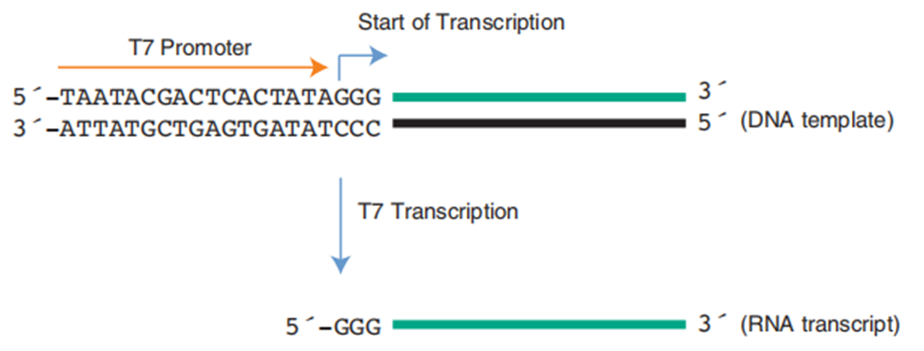
RNA合成
1)室温下按下表顺序配制反应体系:
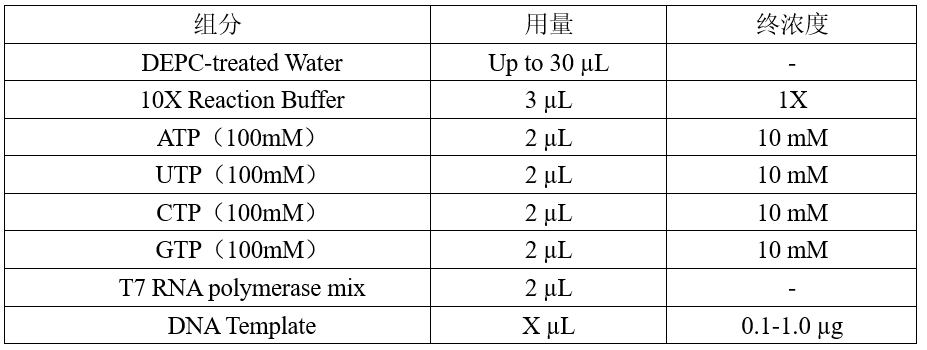
用移液器轻轻混匀各组分,并短暂离心收集,37℃孵育2 h。
2)DNaseⅠ处理(可选)
反应完成后,加入2 µL DNaseⅠ(RNase free),37℃孵育15 min 以去除模板 DNA。
3)合成的RNA经电泳分析、纯化后,置于-80℃储存,可用于下游实验。
RNA纯化
非修饰RNA可采用过柱纯化或酚/氯仿抽提纯化法;修饰RNA推荐使用过柱纯化法;对产物片段大小要求较高则推荐使用切胶回收纯化。
1、酚/氯仿纯化法:酚/氯仿抽提可去除蛋白和大部分游离核苷酸。
(1)加入160 µL DEPC-treated Water将产物稀释至180 µL;
(2)加入20 µL 3 M的醋酸钠(pH 5.2)到稀释后的产物中,用移液器充分混匀;
(3)加入200 µL的酚/氯仿混合液(1:1)进行抽提,室温12,000 rpm(13,400 × g)离心5 min,将上层溶液(水相)转移至新的RNase-free的EP管中;
(4)加入与水相等体积的氯仿抽提2次,收集上层水相;
(5)加入2倍体积的无水乙醇,混匀,-20℃孵育30 min,4℃ 12,000 rpm(13,400 × g)
离心15 min;
(6)弃上清并加入500 µL预冷的70%乙醇洗涤RNA沉淀,4℃ 12,000 rpm(13,400 × g)离心,弃上清;
(7)开盖干燥2 min,加入20 - 50 µL RNase-free ddH2O或其他缓冲液溶解RNA沉淀;
(8)-80℃保存。
2、柱纯化*:柱纯化可以去除蛋白和游离核苷酸。
纯化前加入80 µl DEPC-treated Water将产物稀释至100 µl,再按柱纯化说明书进行纯化。
*请根据RNA产量对所需柱子数量进行预估以避免超出结合柱的承载能力。
RNA质检
1、琼脂糖电泳法
为了确定RNA的大小,完整度以及质量,需要进行琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳进行检测。
2、Agilent 2100 Bioanalyzer 检测法
2100 可以用来评估RNA完整度及质量,它仅需要少量的RNA进行分析,高品质的RNA在电图上应呈现明显且锐利的峰。
注意事项
1、试验过程中请穿戴实验服、一次性乳胶手套及口罩、使用RNase-free耗材,所有试剂均使用RNase free H2O配制,避免RNase污染。
2、模板的使用:建议纯化后再作为模板体外转录,以避免RNase、蛋白、RNA及盐残留对体系的影响。
3、配制体系时,10X Reaction Buffer放置至室温才使用,避免低温下溶液中的亚精胺造成模板沉淀。
问题解答
1、低产量全长RNA
如果转录模板是产生全长的RNA,其产量可能明显低于预期;DNA模板里包含的污染物可能会抑制RNA聚合酶的活性,或者可能由于DNA的浓度不正确。或者说,DNA模板可能需要额外的纯化,建议用酚氯仿抽提法。
2、低产量短转录本
短转录本(<0.3 kb)的高产量可以通过增加孵育时间和增加模板的量来获得。孵育反应长达16 h或者使用多达2 µg的模板将会有助于实现最大产量。
3、RNA产物片段大于预期
如果电泳显示产物条带大于预期,可能原因:①质粒模板可能没有完全线性化;②有义链3'端为突出结构;③RNA存在未完全变性的二级结构。建议确认模板结构,并将电泳方式由琼脂糖胶换成变性胶来检测RNA产物。
4、RNA转录本在变性胶中污染
如果RNA开始出现在变性的聚丙烯酰胺胶或琼脂糖凝胶上(例如污染),这意味着RNA酶污染了DNA模板。污染有RNA酶的DNA模板会影响合成转录本的长度(比预期的的转录本短)。如果质粒模板污染了RNA酶,有必要用酚氯仿方法抽提一遍,再沉淀DNA,用RNase-free Water溶解。
5、转录产物产量低
模板与产量密切相关,实验组产量明显低于对照组,可能原因:①实验模板中有抑制反应的成分;②实验模板本身原因。建议做一个对照组,一个实验组。若对照组产量正常但实验组产量低,说明实验模板本身原因导致产低,请尝试以下方案解决:
a.重新纯化模板;b确定模板定量以及其完整性;c.延长37℃反应时间;d.加大模板投入量;e.尝试其它的启动子和RNA聚合酶。
6、产物电泳拖尾现象
电泳过程中有拖尾现象,可能原因:①实验操作过程被RNA酶污染;②DNA模板被RNase污染。体系中的RNA酶抑制剂只能抑制痕量的RNA酶残留,建议重新纯化模板DNA,并在实验过程中使用RNase-free的枪头和EP管,佩戴一次性乳胶手套和口罩,所有试剂均用RNase-free ddH2O配制。
- 上一篇:没有了
- 下一篇:没有了
- 返回栏目页
公司地址:武汉市江岸区中山大道岳飞街21号金源世界中心D座1201-1203室
Copyright © 2024 Medjaden All Rights Reserved. 版权所有 不得翻录
 鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
联系人:陈经理 - 科研支持




 关注美捷登公众号
关注美捷登公众号
 美捷登公益直播
美捷登公益直播

