- 首页
- 论文服务
- 科研支持
- 访学通
- 美捷登学院
T7转录试剂盒(生物素标记)
GS™ T7 Biotin Labeled RNA Synthesis KitR0402 3 rxns
Store at -20℃
产品简介
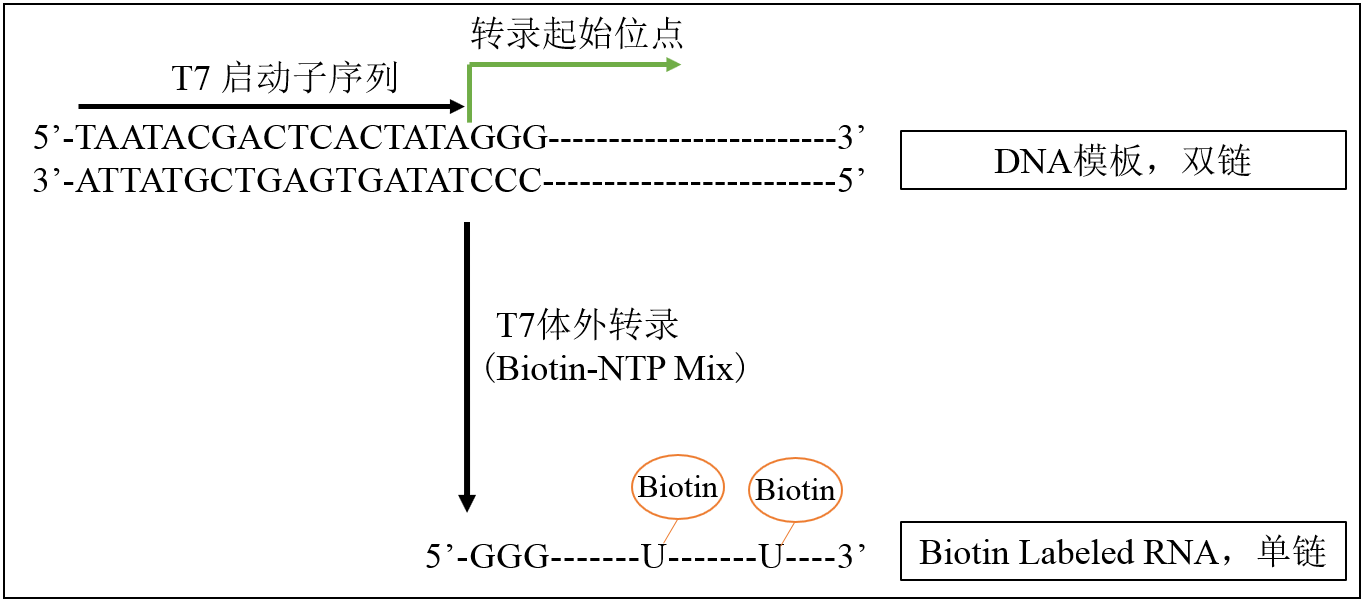
本试剂盒利用重组T7 RNA聚合酶,以Biotin-NTP Mix为底物,在体外快速高效合成含生物素标记的RNA。合成的生物素标记RNA可用于RNA Pull-down、Northern Blot、原位杂交等实验。使用1 μg DNA模板时,每次反应中RNA生成量不低于50 μg。
产品组分

*:使用20μL体系时,本试剂盒可进行3次转录反应。
**:Biotin-NTP Mix内含ATP, GTP, CTP, UTP和Biotin-16-UTP,其中UTP与Biotin-16-UTP的比例为2:1。
保存条件
低温运输,-20℃保存,保质期12个月。
自备材料
1.RNA纯化回收:TRIzol LS Reagent、磁珠或过柱纯化试剂盒。
2.RNA检测:微量分光光度计、Qubit荧光计、琼脂糖凝胶电泳设备或Agilent 2100等。
3.其他试剂与耗材:RNase-Free或DEPC处理的PCR管和吸头等。
操作流程
1.DNA模板制备
使用含有T7启动子序列的线性化质粒、PCR产物或合成的寡核苷酸为模板,模板应保证高纯度高质量,避免RNase、蛋白质、RNA或盐类污染。
以线性化质粒为模板的,应使质粒线性化形成平末端或5’突出末端,线性化后应进行琼脂糖凝胶电泳检测,确保线性化切割完全,并纯化回收。在20 μL反应体系中,线性化质粒模板可使用0.5~1 μg。
以PCR产物为模板的,可在引物上加入T7启动子序列进行PCR扩增,确保T7启动子序列的方向正确。PCR产物应进行琼脂糖凝胶电泳检测,确保条带单一且大小正确,并纯化回收。在20 μL反应体系中,PCR产物模板可使用0.2~0.75 μg。
2.RNA转录合成
1)从试剂盒中取出各组分试剂,冰上融化颠倒混匀,短暂离心后置于冰盒上备用。
2)按照下表依次添加试剂,配置反应体系。
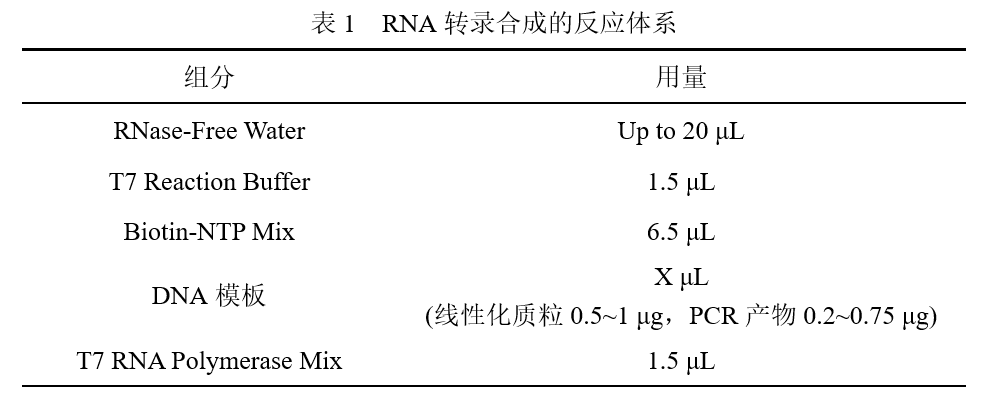
3)颠倒混匀并短暂离心,置于PCR仪上37℃孵育2 h。合成小于300 nt的短链RNA时应37℃孵育4~16 h。
3.DNA模板去除
向反应液中依次添加68 μL RNase-Free Water,10 μL 10× DNase Reaction Buffer,和2 μL RNase-Free DNase I (1 U/μL),置于PCR仪上37℃孵育15 min。
4.纯化回收
使用TRIzol LS Reagent、磁珠或RNA柱纯化试剂盒,纯化回收生物素标记的RNA。
5.RNA检测
1)定量检测
使用微量分光光度计(如Nanodrop)或Qubit荧光计检测RNA的浓度和纯度。
2)电泳检测
使用琼脂糖凝胶电泳或Agilent 2100检测RNA的大小和完整性,生物素标记的RNA分子量增大,条带大小可能比预期偏大。使用非变性琼脂糖凝胶电泳时,可以先将RNA置于65℃孵育10 min,再上样检测。
- 上一篇:没有了
- 下一篇:没有了
- 返回栏目页
公司地址:武汉市江岸区中山大道岳飞街21号金源世界中心D座1201-1203室
Copyright © 2024 Medjaden All Rights Reserved. 版权所有 不得翻录
 鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
联系人:陈经理 - 科研支持




 关注美捷登公众号
关注美捷登公众号
 美捷登公益直播
美捷登公益直播

