- 首页
- 论文服务
- 科研支持
- 访学通
- 美捷登学院
RIP试剂盒RNA Immunoprecipitation Kit
Cat.No. P0101 (12T)
Cat.No. P0102 (24T)
Sufficient reagent for RIP assays per kit
Store at -20℃ to 4℃
背景介绍
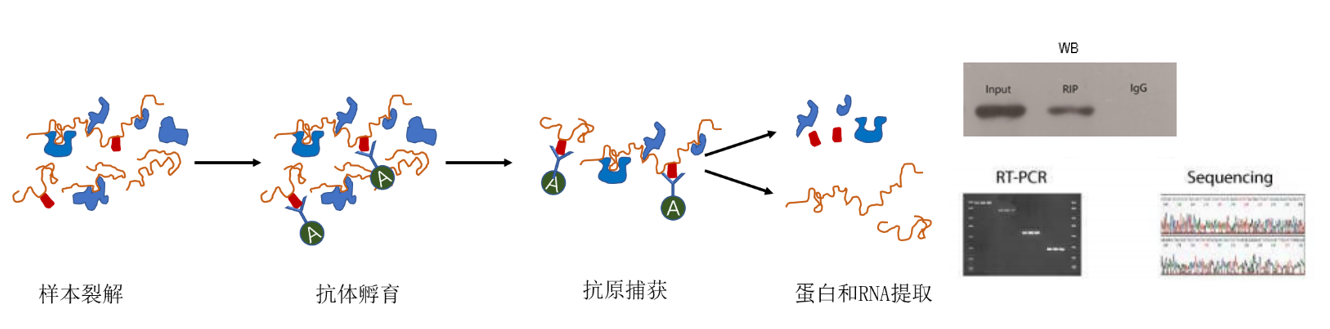
RNA Immunoprecipitation(RIP)是研究细胞内RNA与蛋白结合的技术,是了解转录后调控网络动态过程的有力工具。
RIP利用特异性抗体对目标蛋白进行捕获,实现目标蛋白-RNA复合物的富集,再通过对复合物中蛋白和RNA的检测和分析,探索分子间相互结合关系。分离复合物中的RNA,经过逆转录或构建cDNA文库,最后利用基因特异性分析技术(PCR、qRT-PCR)或高通量分析技术(高通量测序、基因芯片),分析复合物中RNA的类型及多少;分离复合物中的蛋白,通过WB或质谱等方法,还可以用来做质控、检测目标蛋白抗体质量以及研究与目标蛋白结合的其他互作蛋白。
应用范围
l 与目标蛋白结合的RNA及其他相互作用蛋白分析;
l RBP结合RNA motif鉴定;
l 不适用膜结合蛋白、DNA结合蛋白(组蛋白、核仁蛋白等)的RIP实验。
实验原理图
试剂盒组分
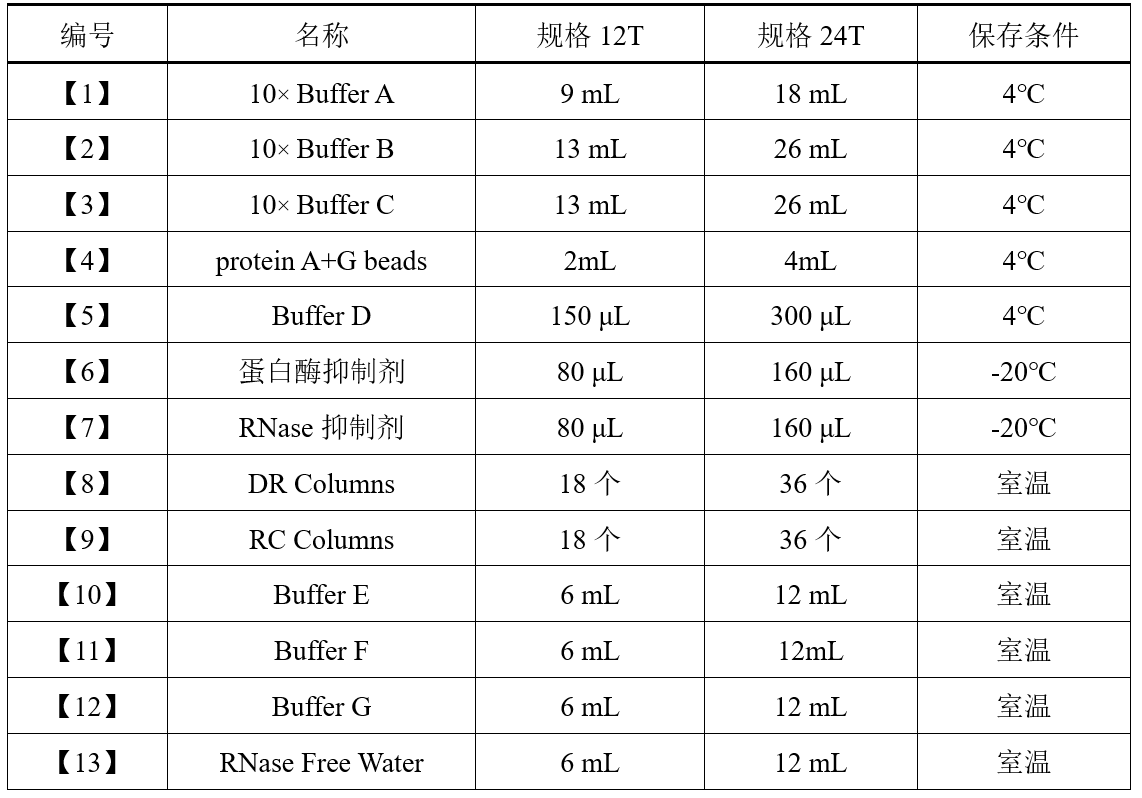
注:对照(IgG)组与实验(IP)组消耗试剂量相同,一次免疫沉淀(含Input组、IP组及IgG组),要消耗2T次试剂量。
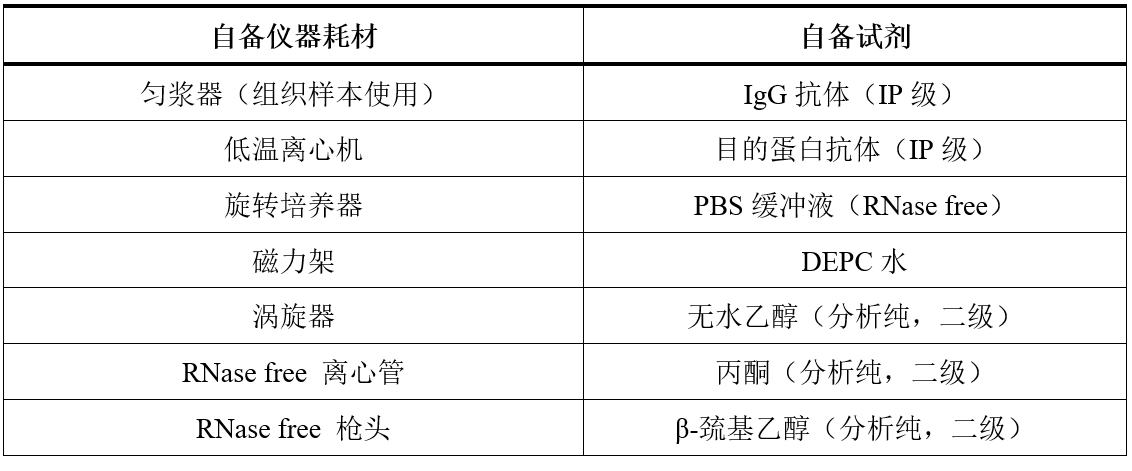
自备材料
实验前试剂准备
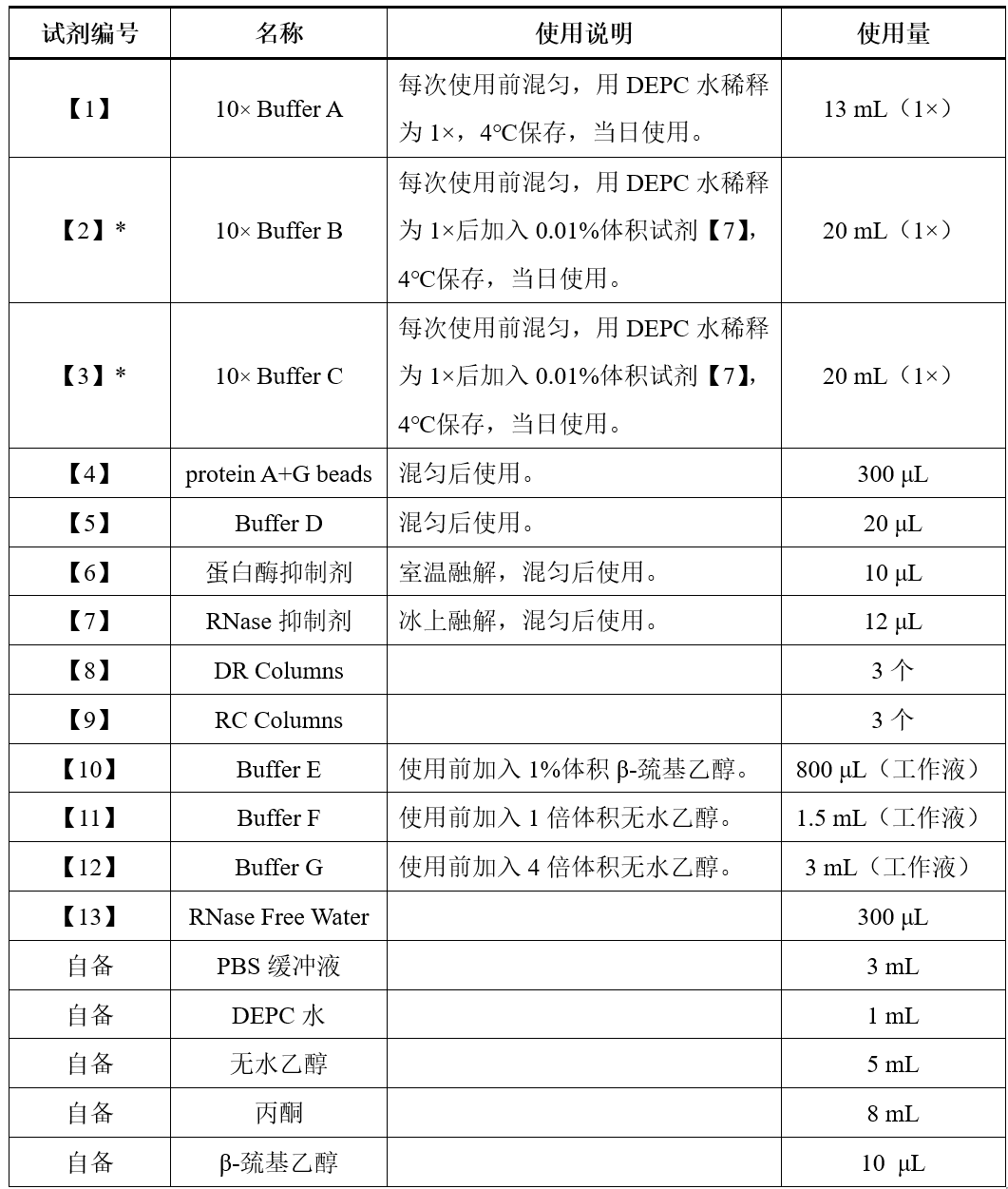
注:1)以上试剂每次实验前需新鲜配置
2)* 标记表示该试剂根据实验需求选择性使用
实验操作流程图
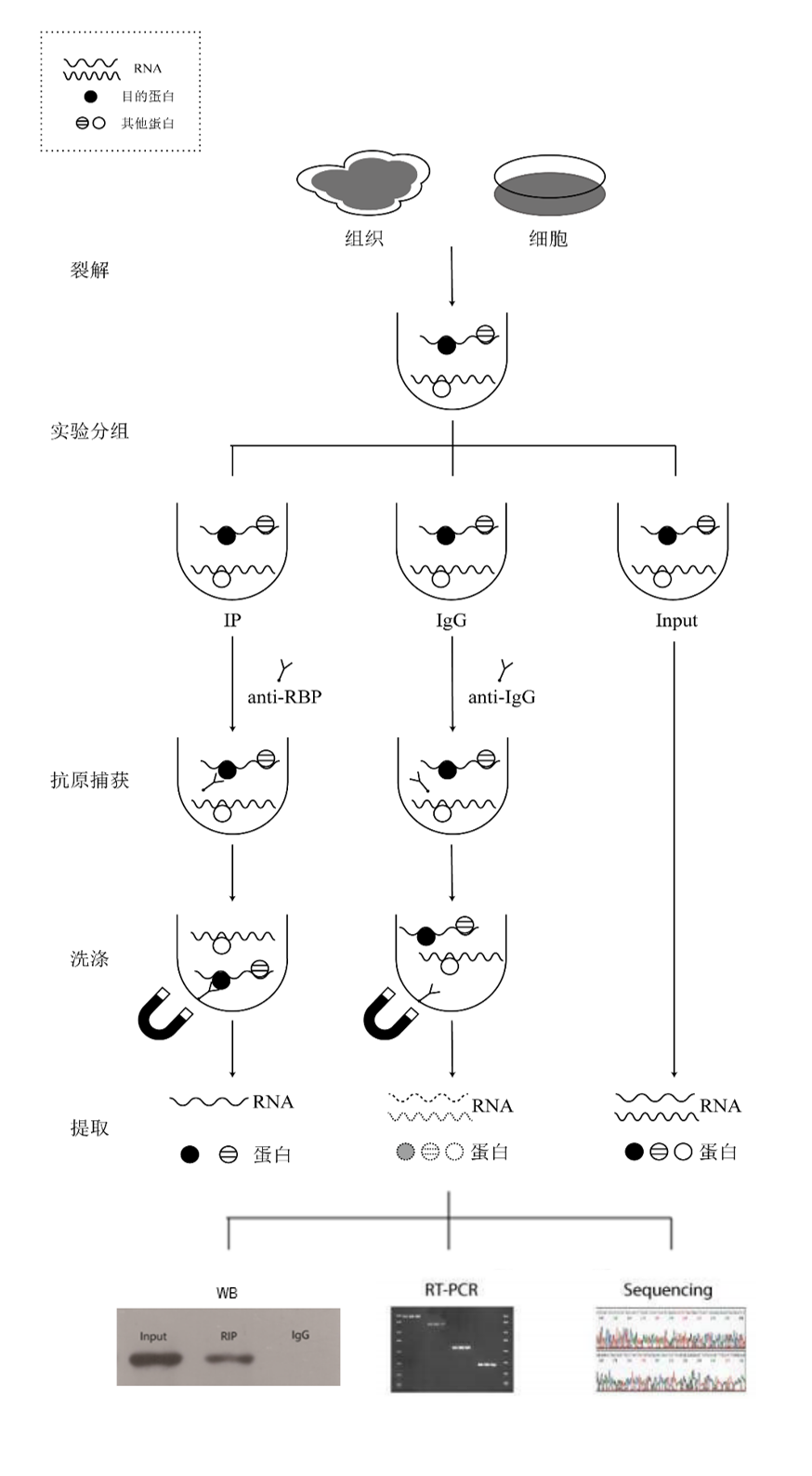
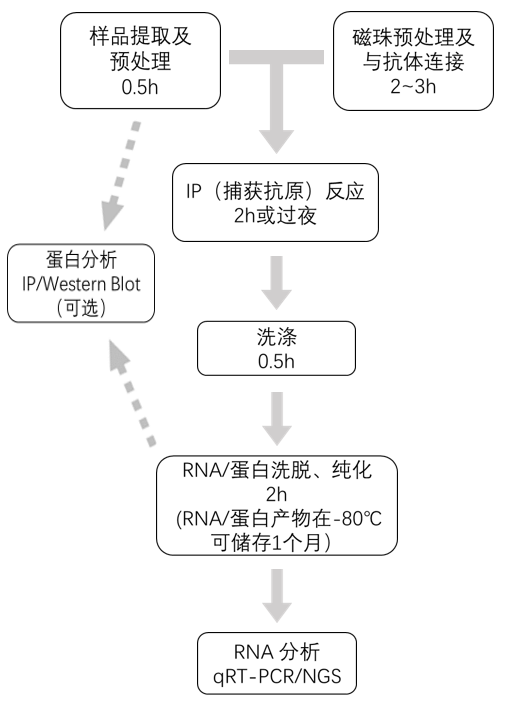
实验时间管理
1.目的蛋白
1)目的蛋白抗体和IgG抗体应种属一致,且为IP级。使用量一般为5ug,或参考抗体说明书中推荐的用量。
2.细胞裂解
每个RIP使用的细胞总数必须根据RNA结合蛋白的丰度进行优化。如目的蛋白内源表达低,就需要增加细胞用量。通常,一次RIP反应1E7的细胞量对应1mL 稀释后的Buffer A,但最高3E7的细胞量也有测试过可以成功裂解。
3.RNase控制
在整个实验中,应采取所有标准预防措施以尽量减少RNase污染。如所有步骤都应戴手套,所有接触细胞或细胞裂解物的仪器、玻璃器皿和塑料器皿应经认证的无核酸酶或应使用DEPC或其他RNase灭活试剂进行预处理。试剂盒含有RNase抑制剂,请按协议中说明进行操作。
4.细胞样品准备
1)贴壁细胞
l刮取细胞
①从培养皿或培养板上刮下细胞,转移到离心管,细胞计数;
②1000 rpm离心5分钟收集细胞,弃上清,用预冷的PBS洗涤细胞两次;
③4℃,1000 rpm离心5分钟收集细胞,弃上清(可放-80℃保存)。
l消化液消化收取细胞
①弃掉培养基,用PBS冲洗细胞一次;
②加胰蛋白酶消化解离细胞;
③加10倍体积的完全细胞培养基终止消化,收集细胞计数,转移到离心管;
④1000 rpm离心5分钟收集细胞,弃上清,用预冷的PBS洗涤细胞两次;
⑤4℃,1000 rpm离心5分钟收集细胞,弃上清(可放-80℃保存)。
2)悬浮细胞
①将细胞收到锥形管中,细胞计数。
②1000 rpm离心5分钟收集细胞,弃上清。
③将细胞重悬在预冷的10ml PBS中清洗。4℃,1000 rpm离心5分钟收集细胞,弃上清。
④重复步骤3(可放置-80℃保存)。
注意事项:
a)保存时间不宜过久,新鲜的样本有利于RIP实验的成功。
实验操作
1.样品提取
●组织样品:
1)取100 mg新鲜组织加入1 mL PBS(自备)进行洗涤,去除血液等;
2)将洗净组织放入匀浆器,加入1 mL Buffer A(1×)工作液(DEPC水10倍稀释【1】,使用前加入1%体积蛋白酶抑制剂【6】和1%体积RNase抑制剂【7】),进行研磨,期间每研磨1 min置于冰上冷却30 s,充分研磨后转置于1.5 mL无RNase离心管;
3)4℃,14000 g离心,10 min取上清。
●细胞样品:
1)1×107个收集的细胞加入1 mL Buffer A(1×)工作液(DEPC水10倍稀释【1】,使用前加入1%体积蛋白酶抑制剂【6】和1%体积RNase抑制剂【7】),吹打混匀,置于冰上裂解10 min,期间涡旋重悬2次,每次5 s;
2)4℃,14000 g离心,10 min取上清。
注意事项:
a)使用无RNase的吸头及离心管,尽量降低环境中RNase对实验的影响;
b)PBS(自备)洗涤应轻柔,勿使细胞破碎;
c)细胞裂解时,应温和,防止核酸析出聚集成团;
d)组织样品离心后取上清,应避免吸取到脂肪等不溶杂质;
2.样品预处理
1)取100μL上清作为Input对照(标记为1号管),剩余900 μL置于无RNase离心管中。
2)*在900μL上清中加入100 μL protein A+G beads【4】,于4℃,10转/min旋转反应10min;
3)*置于磁力架取上清,弃磁珠;
注意事项:
a)如果当天不能进行第5步,Input对照组上清液需加入Buffer E立即放置-80℃保存。如当天可以进行第5步,可先加入Buffer E 后保存在-20℃。也可合理安排实验时间,在第5步捕获抗原前半小时完成样品的处理,可减少反复冻融对样品的伤害。
b)2)*3)*步骤为可选择步骤,使用protein A+G beads【4】对样品进行预处理,对改善磁珠非特异结合有一定的帮助;
3.磁珠预处理
1)取200 μL protein A+G beads【4】,加入Buffer A(1×)【1】1 mL,涡旋5 s,置于磁力架,弃去上清;
2)重复洗涤1次;
3)加入Buffer A(1×)【1】1 mL,Buffer D【5】20 μL,于4℃,10转/min旋转反应30 min;
4)置于磁力架弃上清;
5)加入Buffer A(1×)【1】1 mL,涡旋洗涤5 s,置于磁力架弃上清;
6)加入Buffer A(1×)【1】1 mL,充分混匀后分为2份,各500 μL;
7)置于磁力架弃上清,分别标记为2号管(RIP),3号管(IgG)。
注意事项:
a)如果产物用于测序,Buffer D可以选择不添加,其中的成分或对测序有影响;
4.抗体与磁珠连接
1)经封闭处理的两管beads各加入Buffer A(1×)【1】1 mL,RIP抗体(2号管)或IgG(3号管)5 μg,于4℃,10转/min旋转反应1~2 h;
2)反应完成后,置于磁力架弃上清;
3)使用Buffer A(1×)【1】1 mL涡旋洗涤5 s,置于磁力架弃上清;
4)重复洗涤1次,置于磁力架弃上清。
5.捕获抗原
1)在结合了RIP抗体(2号管)或IgG(3号管)的磁珠中加入350 μL Buffer A(1×)【1】、组织或细胞裂解上清450 μL,4℃、10转/min旋转反应2h~过夜。
2)反应完成后,置于磁力架弃上清。
注意事项:
a)长时间的反应会增加背景;
b)适当的增加反应时间或许对目标的捕获有利;
c)如果抗原的丰度较低,可适当减少Buffer A(1×)【1】的加入量,更好的选择是在提取的时候使用更大的组织或细胞量。
6.洗涤
1)在磁珠复合物中加入1 mL Buffer B(1×)【2】或Buffer C(1×)(strong)【3】,涡旋洗涤2 min,置于磁力架弃上清;
2)重复洗涤5~10次。
注意事项:
a)多次洗涤对改善背景有一定的帮助;
b)涡旋转速推荐2500×g;
c)如果想进一步降低背景,可以使用Buffer C(1×)(strong)【3】进行洗涤,但或会破坏目标复合物之间的互作。
7.提取蛋白与RNA
1)洗脱结合在磁珠上的复合物(Input样品使用相同方法提取)
①在磁珠复合物中加入Buffer E 300 μL【10】, Input样本中加入Buffer E 200 μL【10】,涡旋30 s;
②置于磁力架,收集上清;
2)过柱去除DNA
①将上清加入DR Columns【8】滤柱;
②14000 g,离心2 min,收集滤液;
③在滤液中加入等体积的70%乙醇,移液器吹打3~5次;
3)过柱纯化RNA
1.将混有70%乙醇的滤液加入RC Columns【9】滤柱;
2.12000 g,离心30~60 s,将含滤液收集用于蛋白提取;
3.在RC Columns【9】滤柱上加入500 μL Buffer F(含乙醇)【11】;
4.12000 g,离心30~60 s,弃滤液;
5.在RC Columns【9】滤柱上加入500 μL Buffer G(含乙醇)【12】;
6.12000 g,离心30~60 s,弃滤液;
7.在RC Columns【9】滤柱上加入500 μL Buffer G(含乙醇)【12】;
8.12000 g,离心30~60 s,弃滤液;
9.空柱12000 g,离心2 min,弃滤液;
10.将滤柱转移至新的无RNase离心管中,加入30~100 μL RNase free water【13】至柱膜中央;
11.室温静置2 min;
12.12000g,离心1 min;
13.收集到的RNA保存于-80℃。
4)蛋白提取
①取第7-3)-②步获得的滤液,加入4倍体积冰冷的丙酮(自备),涡旋混匀30 s;
②冰上放置30 min沉淀蛋白质;
③小心去除上清,加入1 mL无水乙醇(自备),涡旋混匀;
④室温,12000 g,离心3 min,小心去除上清;
⑤短暂离心,彻底吸弃残留的乙醇;
⑥空气干燥5~10 min;
⑦根据下游实验应用,加入缓冲液至蛋白质沉淀中,使其溶解。
注意事项:
a)Input样品量不宜过多,否则会堵塞柱子;
b)反复的对样品进行冻融会造成RNA的降解,确保冻融不超过2次;
c)试剂盒中提供的RNase Free Water【13】不含抑菌剂,室温放置或操作时可能会引入细菌或真菌污染。可使用新的RNase Free Water【13】或DEPC处理水(自备);
d)用DEPC处理水配制70%乙醇;
e)70%乙醇可使用Buffer G(含乙醇)【12】替代;
f)RNase Free Water【13】需垂直滴加到膜上,并静置几分钟后再离心,进行第二次洗脱(滤液再加回柱子再次洗脱)可提高RNA产量。
g)由于洗脱柱的容量及洗脱能力有限,因此如果产物量不够下游实验要求,如测序,可以重复实验,合并产物。
h)溶解蛋白的缓冲液可以是裂解液或PBS,用枪头将蛋白沉淀在管壁上挤压、旋转打散,再小心吹打溶解。不可直接使用loading buffer,否则蛋白沉淀无法溶解。一般添加缓冲液体积建议为50ul。
8.产物分析
1)蛋白产物分析
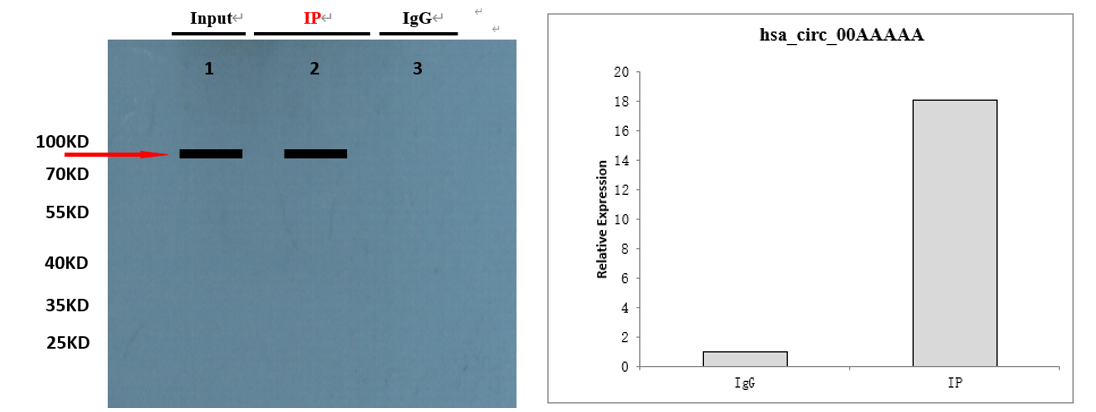
RIP实验洗脱蛋白产量一般较低,可直接取20ul进行WB检测。目的蛋白丰度、富集效率、抗体质量等均可从WB结果中判断,可依据结果对实验条件或操作进行相应调整。
2)RNA产物分析
洗脱纯化的RNA,产物量一般不足以直接测量出浓度,可通过定量RT-PCR(如果已知RBP的结合靶基因),或通过测序技术进行分析。
●qPCR数据处理

3)结果示例图
注意事项:
a)对于反转录,用户可以使用任何商用反转录试剂盒。
b)由于RNA浓度未知,建议取所用反转录体系的最大上样量进行逆转录。
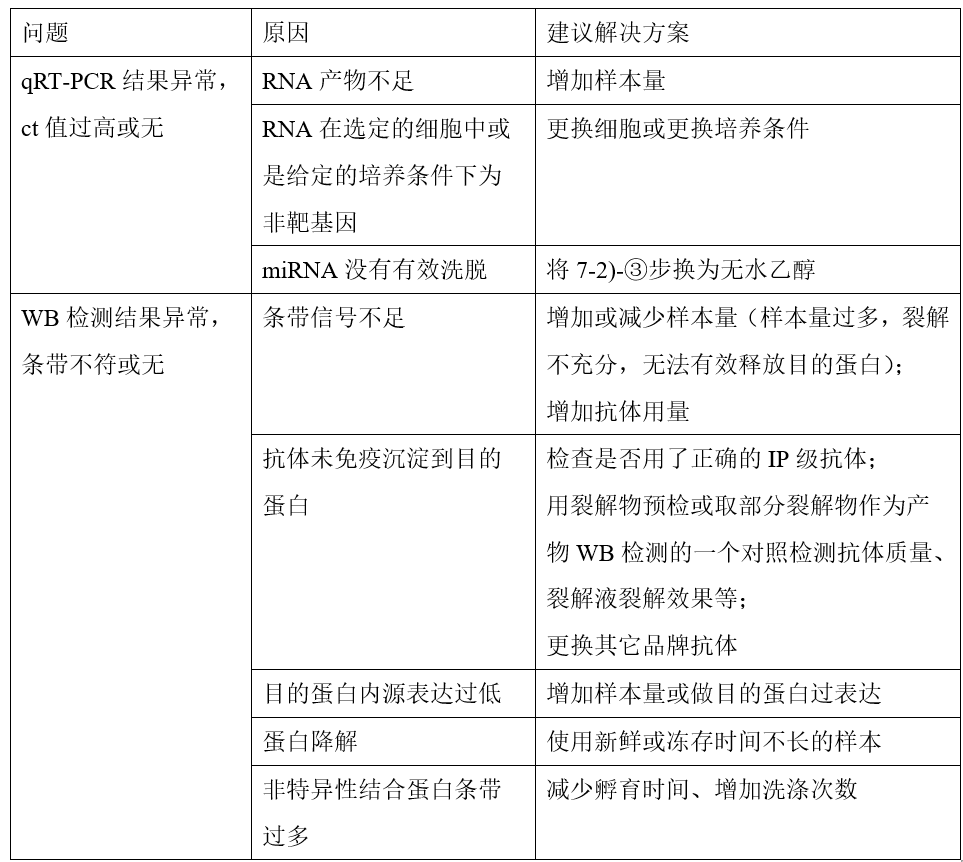
常见问题及处理方法
- 上一篇:没有了
- 下一篇:没有了
- 返回栏目页
公司地址:武汉市江岸区中山大道岳飞街21号金源世界中心D座1201-1203室
Copyright © 2024 Medjaden All Rights Reserved. 版权所有 不得翻录
 鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
联系人:陈经理 - 科研支持




 关注美捷登公众号
关注美捷登公众号
 美捷登公益直播
美捷登公益直播

