- 首页
- 论文服务
- 科研支持
- 访学通
- 美捷登学院
RNA pull-down试剂盒PureBindingTM RNA-Protein pull-down Kit
Cat.No. P0201 (12T)
Cat.No. P0202 (24T)
Sufficient reagent for RNA pull-down assays per kit
Store at-20℃ to 4℃
背景介绍
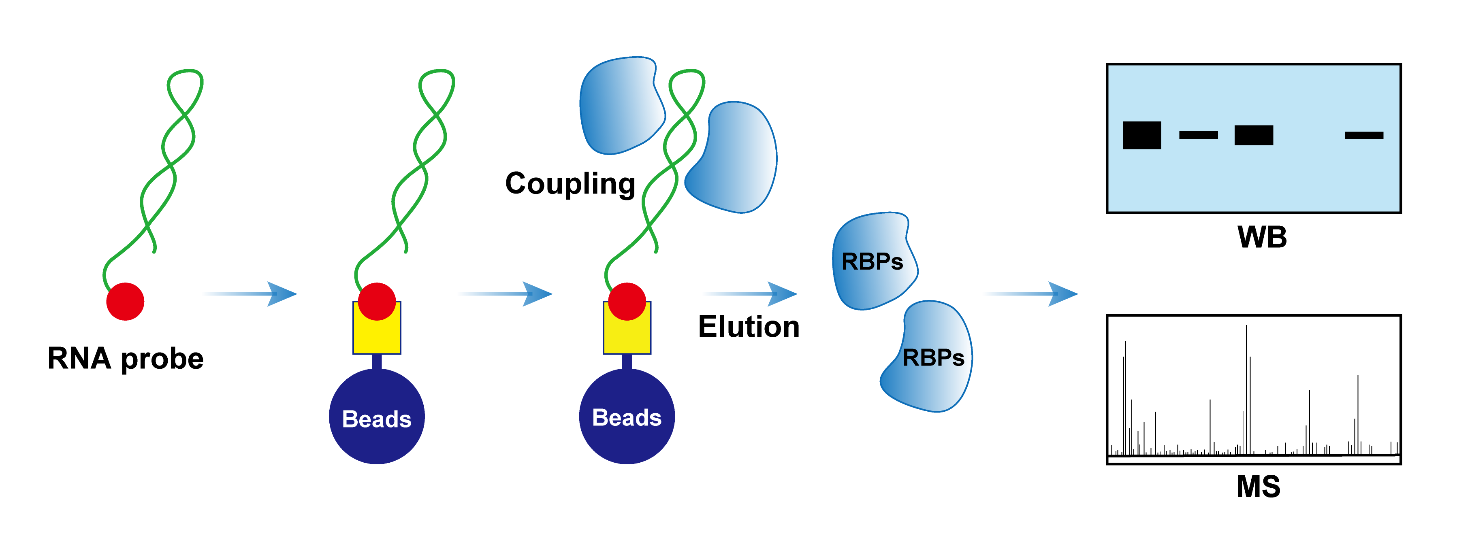
RNA pull-down是检测RNA结合蛋白与RNA之间相互作用的主要实验手段之一。该技术利用体外转录或合成生物素标记RNA模拟天然RNA分子,作为探针,与细胞裂解液孵育。探针与裂解液中的蛋白形成RNA-蛋白质复合物,可被链霉亲和素磁珠特异性结合捕获,从而实现RNA结合蛋白(RBPs)的捕获富集。可通过对RNA pull-down的产物进行Western Blot检测,或者结合质谱实验,对RNA结合蛋白(RBPs)进行检测和筛选。
应用范围
●靶RNA结合蛋白的验证或筛选;
●适用长链、线性RNA探针(模拟靶RNA序列)直接拉取互作蛋白。
实验原理图
试剂盒组分
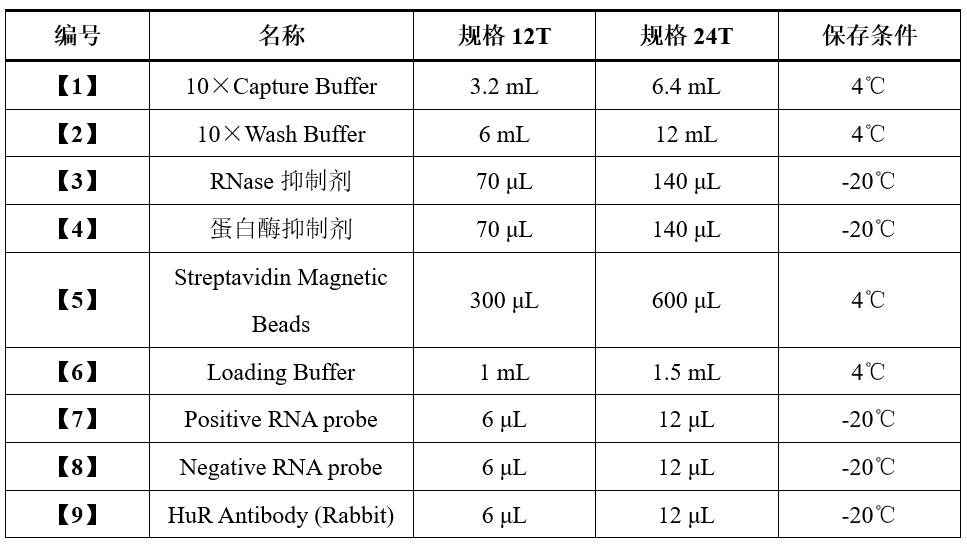
注:对照组与实验组消耗试剂量相同,一次Pulldown实验(含Input组、Pulldown组及一个阴性或阳性对照组),要消耗2T次试剂量。
对照探针说明
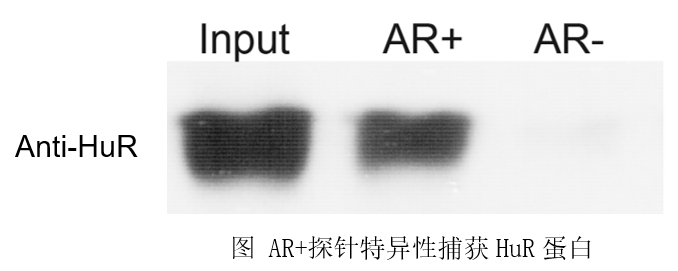
Positive RNA probe(阳性对照探针)包含AR RNA的3'UTR区富含UC的区域,可特异性识别捕获HuR和poly(C)结合蛋白(CP1和CP2)。Negative RNA probe(阴性对照探针)是Positive RNA probe的反义序列,不含有HuR或poly(C)BP结合位点。Positive RNA probe包含以下序列:5’-CUGGGCUUUUUUUUUCUCUUUCUCUCCUUUCUUUUUCUUCUUCCCUCCCUA-3’。
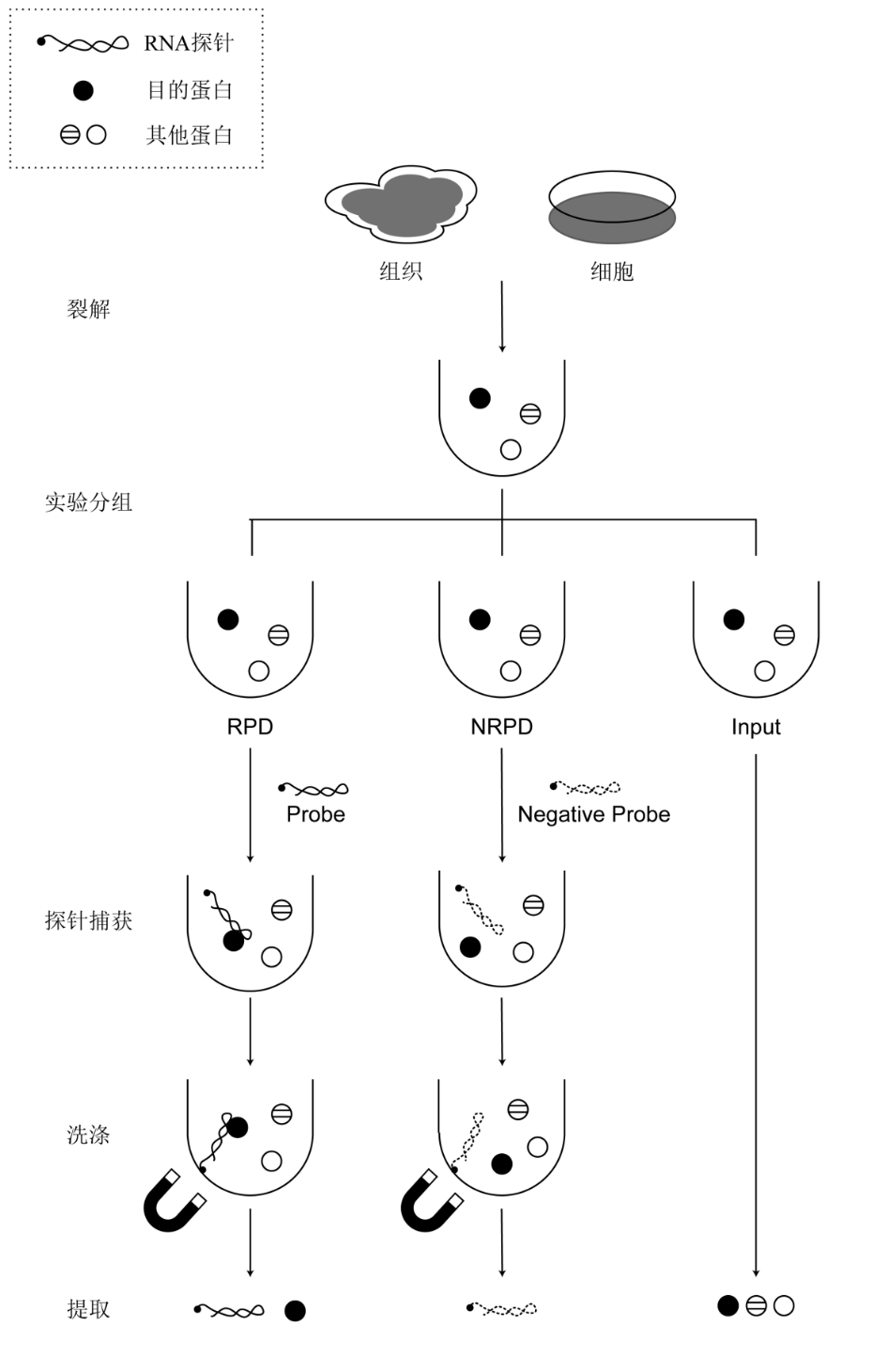
实验操作流程图
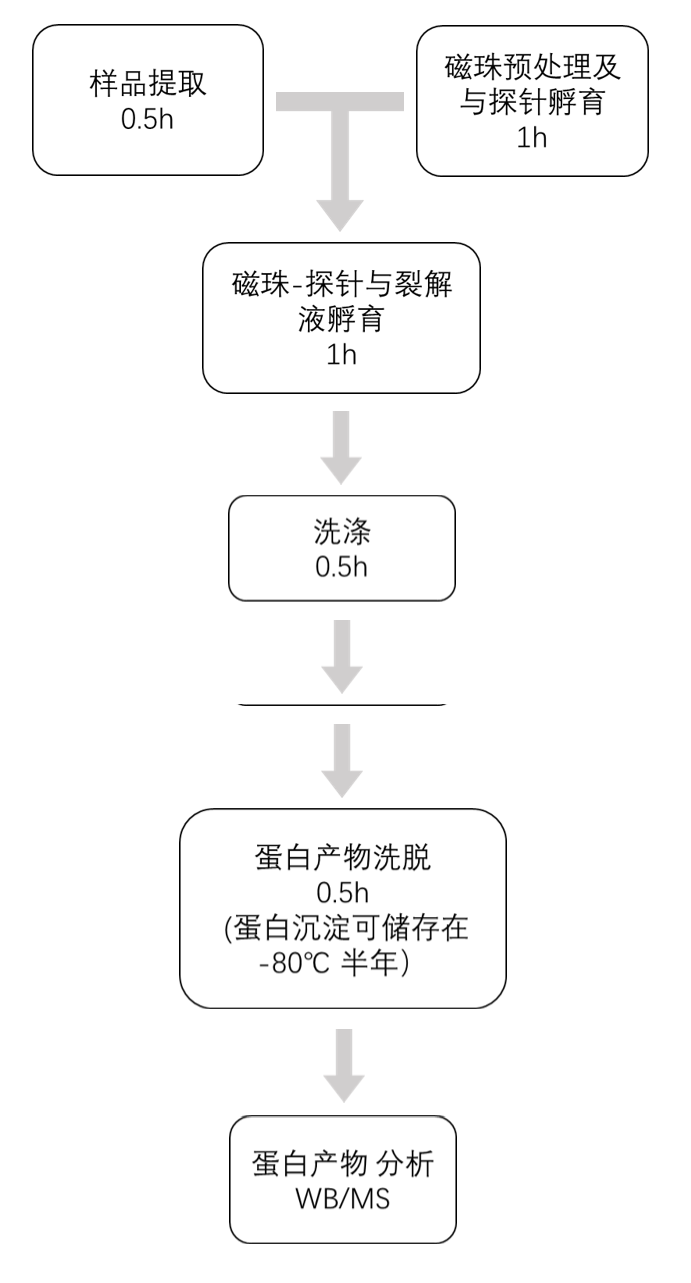
实验时间管理
实验前准备
1.探针制备
1)体外转录或合成方法制备靶RNA和阴性对照探针。末端标记探针相对于随机标记探针更加有利于探针自身二级结构的正确折叠以及与蛋白的结合。
2)实验前RNA探针是否需要进行二级结构的折叠矫正,请咨询相应厂家。
注意事项:
a)本试剂盒适用长链、线性Biotin标记的RNA探针直接拉取蛋白的实验目的。短链探针未作测试,不保证实验效果;
b)阴性对照探针可选用靶RNA的反义序列或是无义序列;
c)不适用反义RNA探针纯化(RAP)技术(将与目标RNA互补的寡核苷酸生物素标记探针,并由此捕获相关互作蛋白和RNA)。
2.RNase控制
在整个实验中,应采取所有标准预防措施以尽量减少RNase污染。如所有步骤都应戴手套,所有接触细胞或细胞裂解物的仪器、玻璃器皿和塑料器皿应经认证的无核酸酶或应使用DEPC或其他RNase灭活试剂进行预处理。试剂盒含有RNase抑制剂,请按协议中说明进行添加操作。
3.细胞样品准备
1)贴壁细胞
●刮取细胞
①从培养皿或培养板上刮下细胞,转移到离心管,细胞计数;
②1000 rpm离心5分钟收集细胞,弃上清,用预冷的PBS洗涤细胞两次;
③4℃,1000 rpm离心5分钟收集细胞,弃上清(可放-80℃保存)。
●消化液消化收取细胞
①弃掉培养基,用PBS冲洗细胞一次;
②加胰蛋白酶消化解离细胞;
③加10倍体积的完全细胞培养基终止消化,收集细胞计数,转移到离心管;
④1000 rpm离心5分钟收集细胞,弃上清,用预冷的PBS洗涤细胞两次;
⑤4℃,1000 rpm离心5分钟收集细胞,弃上清(可放-80℃保存)。
2)悬浮细胞
①将细胞收到锥形管中,细胞计数。
②1000 rpm离心5分钟收集细胞,弃上清。
③将细胞重悬在预冷的10ml PBS中清洗。4℃,1000 rpm离心5分钟收集细胞,弃上清。
④重复步骤3(可放置-80℃保存)。
注意事项:
a)保存时间不宜过久,新鲜的样本有利于RIP实验的成功。
4.自备材料准备
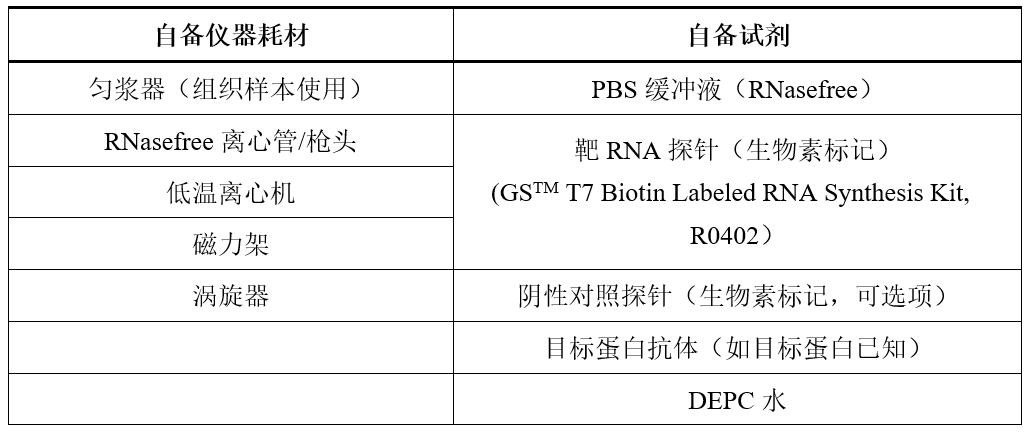
5.试剂准备
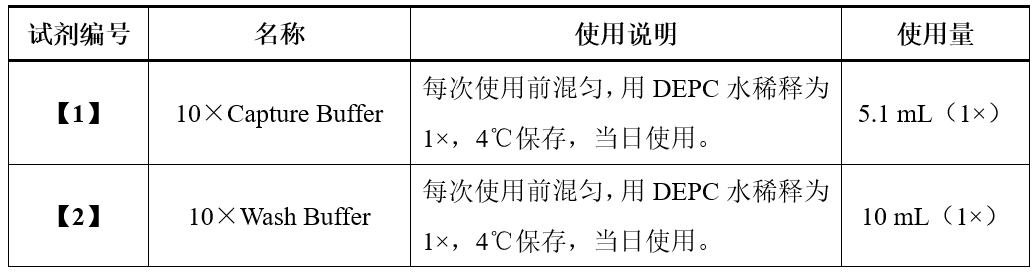
实验操作
1.样品提取
●组织样品
1) Capture Buffer(1×)【1】室温融解混匀,取1 mL置于RNase free离心管中,加入10 μL RNase抑制剂【3】和10 μL蛋白酶抑制剂【4】,制备得到Capture Buffer(1×)【1】工作液*,置于冰盒上备用;
2)取100 mg新鲜组织,使用预冷的PBS(自备)洗涤,去除血液等;
3)将洗净组织放入匀浆器,加入1 mL预冷的 Capture Buffer(1×)【1】工作液*,于冰上充分研磨后转置于1.5 mL RNase free离心管中;
4)4℃,14000 g离心10 min取上清;
5)取50 μL上清作为Input样本(标记为Input管),剩余上清置于RNase free离心管中,尽快进行后续实验,或-80℃短期保存。
●细胞样品:
1)Capture Buffer(1×)【1】室温融解混匀,取1 mL置于RNase free离心管中,加入10 μL RNase抑制剂【3】和10 μL蛋白酶抑制剂【4】,制备Capture Buffer(1×)【1】工作液*,冰浴备用;
2)向1×107个细胞沉淀中加入预冷的1 mL Capture Buffer(1×)【1】工作液*,吹打混匀,置于冰上裂解10 min,期间涡旋2次,每次5 s;
3)4℃,14000 g离心10 min取上清;
4)取50 μL上清作为Input样本(标记为Input管),剩余上清置于RNase free离心管中,尽快进行后续实验,或-80℃短期保存。
注意事项:
a)RNase抑制剂【3】应在冰上融解后使用,蛋白酶抑制剂【4】应在室温融解后使用;
b)使用RNase free的吸头及离心管,尽量降低环境中RNase对实验的影响;
c) 组织样品离心后取上清,应避免吸取到脂肪等不溶杂质;
d)使用细胞样本进行实验时,应避免细胞量过多,防止核酸析出聚集成团;
e)对于低表达丰度的蛋白,样本量可适当增加至3×107个细胞,步骤2(磁珠预处理)中磁珠用量可适当增加至100 μL;
f)合理安排实验时间,可在步骤3(磁珠与探针孵育)期间完成样品处理,避免反复冻融样品发生降解。
2.磁珠预处理
1)取一新的1.5 mL RNase free离心管,分别加入50 μL Streptavidin Magnetic Beads【5】和1 mL Capture Buffer(1×)【1】。涡旋5 s,置于磁力架上,待磁珠被全部吸附,液体变透明后吸弃上清;
2)加入1 mL Capture Buffer(1×)【1】,涡旋5 s,置于磁力架上,待磁珠被全部吸附,液体变透明后吸弃上清;
3)加入1 mL Capture Buffer(1×)【1】,充分混匀后等分为2份,各500 μL;分别标记为RPD管(RNA Pull-Down组)和NRPD管(Negative RNA Pull-Down组)。
3.磁珠与探针孵育
1)经预处理的两管磁珠分别加入50 pmol目的探针(RPD管)或50 pmol对照探针(NRPD管),于4℃、10转/min旋转反应30 min;
2)反应完成后,置于磁力架上,待磁珠被全部吸附,液体变透明后吸弃上清,收集磁珠;
3)两管中分别加入0.5 mL Capture Buffer(1×)【1】涡旋洗涤5 s,置于磁力架弃上清,收集磁珠。
注意事项:
a)使用的探针应带有生物素标记,可通过体外转录或人工合成获得;
b)探针使用量推荐50 pmol/次,或根据实际实验情况调整用量;
c)试剂盒提供的Positive RNA probe【7】和Negative RNA probe【8】,如需使用,建议同时开展实验,每次实验推荐使用探针量为2 μL,使用前冰上融解混匀;
d)试剂盒中提供的对照探针和抗体,可以满足4-5次RNA pull-down。
4.磁珠-探针与裂解液孵育
1)向RPD管和NRPD管的磁珠中分别加入组织或细胞裂解上清450 μL,4℃、10转/min旋转反应1 h;
2)反应完成后,置于磁力架弃上清,收集磁珠。
5.洗涤
1)将Wash Buffer(1×)【2】室温融解并颠倒混匀,取10 mL置于RNase free离心管中,加入1 μL RNase抑制剂【3】和1 μL蛋白酶抑制剂【4】,制备得到Wash Buffer(1×)【2】工作液*,置于冰盒上备用;
2)在收集的磁珠中加入1 mL Wash Buffer(1×)【2】工作液*,涡旋洗涤1 min,置于磁力架弃上清;
3)使用1 mL Wash Buffer(1×)【2】工作液*,重复涡旋洗涤磁珠3~4次;
4)磁力架弃上清,收集磁珠。
6.蛋白产物洗脱
1)向Input管中加入50 μL Loading Buffer【6】;
2)向RPD管和NRPD管中分别加入30~50 μL Capture Buffer(1×)【1】,并加入等体积的Loading Buffer【6】;
3)Input、RPD和NRPD3组蛋白样本,于100℃水煮10 min,3000 rpm离心1 min,收集上清,-80℃保存;
4)获得的产物可直接用于Western Blot检测或质谱检测。
注意事项:
a)使用本试剂盒提供的对照探针进行RNA pull-down实验,可以使用试剂盒提供的HuR Antibody (Rabbit)对产物进行Western Blot检测,抗体稀释比例1:1000,预测大小36KDa。
b)使用其它生物素标记的探针时,根据实验需求选择抗体进行Western Blot检测,抗体使用需参考对应说明书。
c)Loading Buffer会影响蛋白浓度直接测量的准确性,建议直接取20ul进行WB检测(如靶蛋白已知且有相应抗体的情况下)。剩余产物可再做一次质谱分析,一般质谱公司可以处理加了Loading Buffer 的蛋白样品。
d)如果产物量不够下游实验要求,可以重复实验,合并产物。
结果展示
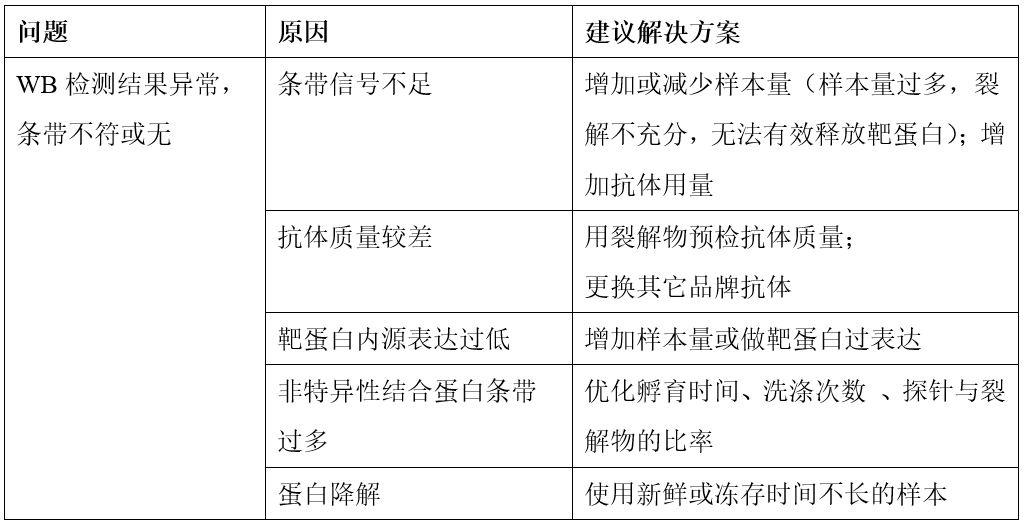
常见问题及处理方法
- 上一篇:没有了
- 下一篇:没有了
- 返回栏目页
公司地址:武汉市江岸区中山大道岳飞街21号金源世界中心D座1201-1203室
Copyright © 2024 Medjaden All Rights Reserved. 版权所有 不得翻录
 鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
鄂ICP备11002610号-1
鄂公网安备42010202000197
联系电话:027-85567377
联系人:陈经理 - 科研支持




 关注美捷登公众号
关注美捷登公众号
 美捷登公益直播
美捷登公益直播

